手性硫亚胺是一类重要的合成砌块,在生物活性分子构建中发挥着关键作用。然而,硫原子对过渡金属催化剂具有较强的配位与毒化效应,导致其不对称合成长期面临严峻挑战。目前,能够高效构建手性硫亚胺的不对称催化方法仍然有限,尤其是通过一步反应同时构建包含硫手性中心在内的多个立体元素,依然存在显著困难(图1b)。近日,小说网
李兴伟/肖纪超团队基于前期研究基础(J. Am. Chem. Soc. 2025, 147, 38931–38941),通过巧妙的底物设计与配体调控,发展了一种铜催化的自由基接力策略,成功实现了大位阻末端炔烃的三氟甲基-硫亚胺化反应,高效构建了轴手性乙烯基硫亚胺类化合物(图1d)。本工作的主要亮点包括:(1)通过巧妙的底物设计,实现铜-硫亚胺物对原位生成的高活性瞬态乙烯基自由基的对映选择性捕获;(2)精准调控了反应的化学选择性、区域选择性、非对映选择性以及对映选择性。(3)结合实验与理论计算,阐明反应经Cu(III)中间体的对映选择性还原消除过程,并揭示底物中C–H···F相互作用对高对映选择性的关键影响。相关研究成果发表于Angew. Chem. Int. Ed. 2026, e23530。
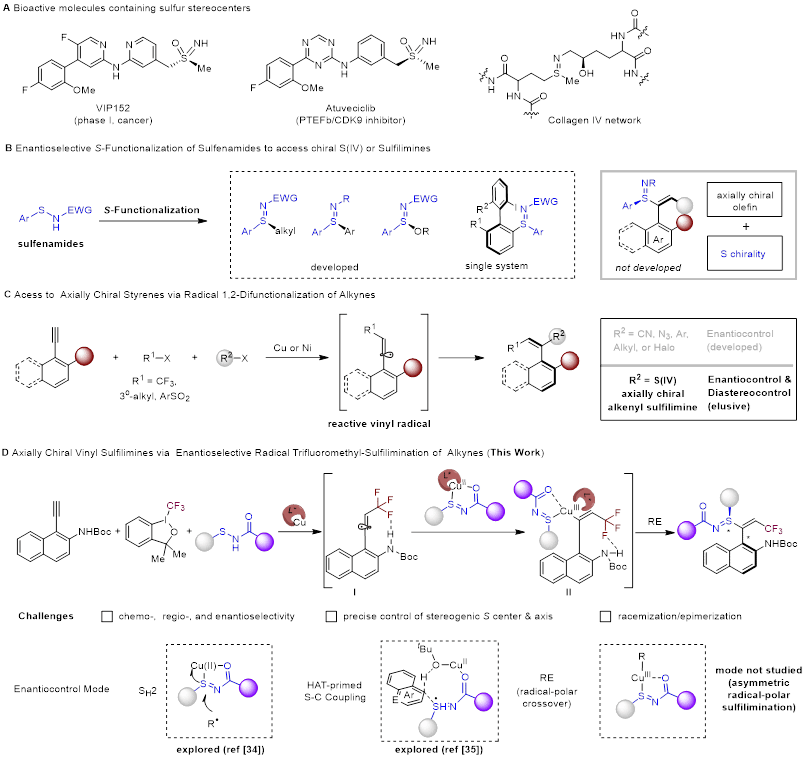
图1研究背景和反应设计
手性硫原子中心广泛存在于诸多生物活性分子(如已获FDA批准的药物及农用化学品)中,是重要的药效团与结构单元。其中,硫亚胺作为硫氧化物的氮类似物,具有独特的四价硫(S(IV))立体中心。近年来的研究表明,硫亚胺在胶原蛋白Ⅳ网络等生物体系中被发现,其优异的物理化学性质与体外活性使其展现出作为新型硫药效团及生物电子等排体的巨大潜力。与合成手性磺酰亚胺、亚砜及磺酰胺等已较为成熟的策略相比,手性S(IV)硫亚胺的合成方法仍相对有限。此外,由于sp³杂化的S(IV)中心存在孤对电子,硫原子的锥形翻转可能导致其消旋能垒较低,进一步增加了不对称合成的难度。传统上,硫亚胺主要通过硫醚的对映选择性亚胺化反应制备。然而,该策略通常依赖于硫醚两侧取代基在空间或电子性质上的显著差异,并需在强氧化或强碱条件下进行,这些因素严重限制了底物的普适性与产物的结构多样性。
近年来,以次磺酰胺为前体的不对称硫官能化反应逐渐发展成为构建手性硫亚胺的有力替代途径。尽管如此,目前报道的方法大多仍局限于双电子离子型机理。相比之下,自由基化学凭借其反应条件温和、官能团兼容性好等优势,已成为现代有机合成中构筑功能分子、设计高分子材料及开发创新药物的重要工具。值得关注的是,2025年李兴伟/肖纪超团队通过氢原子转移(HAT)引发的外球自由基-自由基偶联,实现了(杂)芳烃的C-H键直接硫亚胺化(J. Am. Chem. Soc. 2025, 147, 38931–38941)。近期,刘心元、顾强帅、董哲与洪鑫团队也报道了通过对映选择性SH2自由基偶联,实现烷基卤化物与次磺酰胺的不对称偶联(Nat. Chem. 2025, 18, 142-151)。尽管取得了这些重大进展,但烯基-芳基或烯基-烷基的硫亚胺的合成仍然存在挑战。此外,多重手性硫胺的合成仍有许多问题尚未解决,尤其是轴手性硫胺的的研究仅有一例报道。基于团队长期以来致力于通过炔烃官能团化合成轴手性烯烃的启发,通过芳基炔烃与次磺酰胺的自由基接力实现了轴手性乙烯基硫亚胺的构建。
结果与讨论:
作者首先使用苯乙炔1a作为模板底物,Togni-I 2为自由基前体,次磺酰胺3a为硫源,Cu(MeCN)4PF6为催化剂对手性配体进行了大量筛选,确定得到构建单一硫手性反应的最优条件。接着作者对炔烃和次磺酰胺的底物范围进行考察,无论是芳环上带有给电子基团还是吸电子基团,或烷基的底物均能以良好的收率、优异的立体和对映选择性得到烯基硫亚胺产物(图2)。
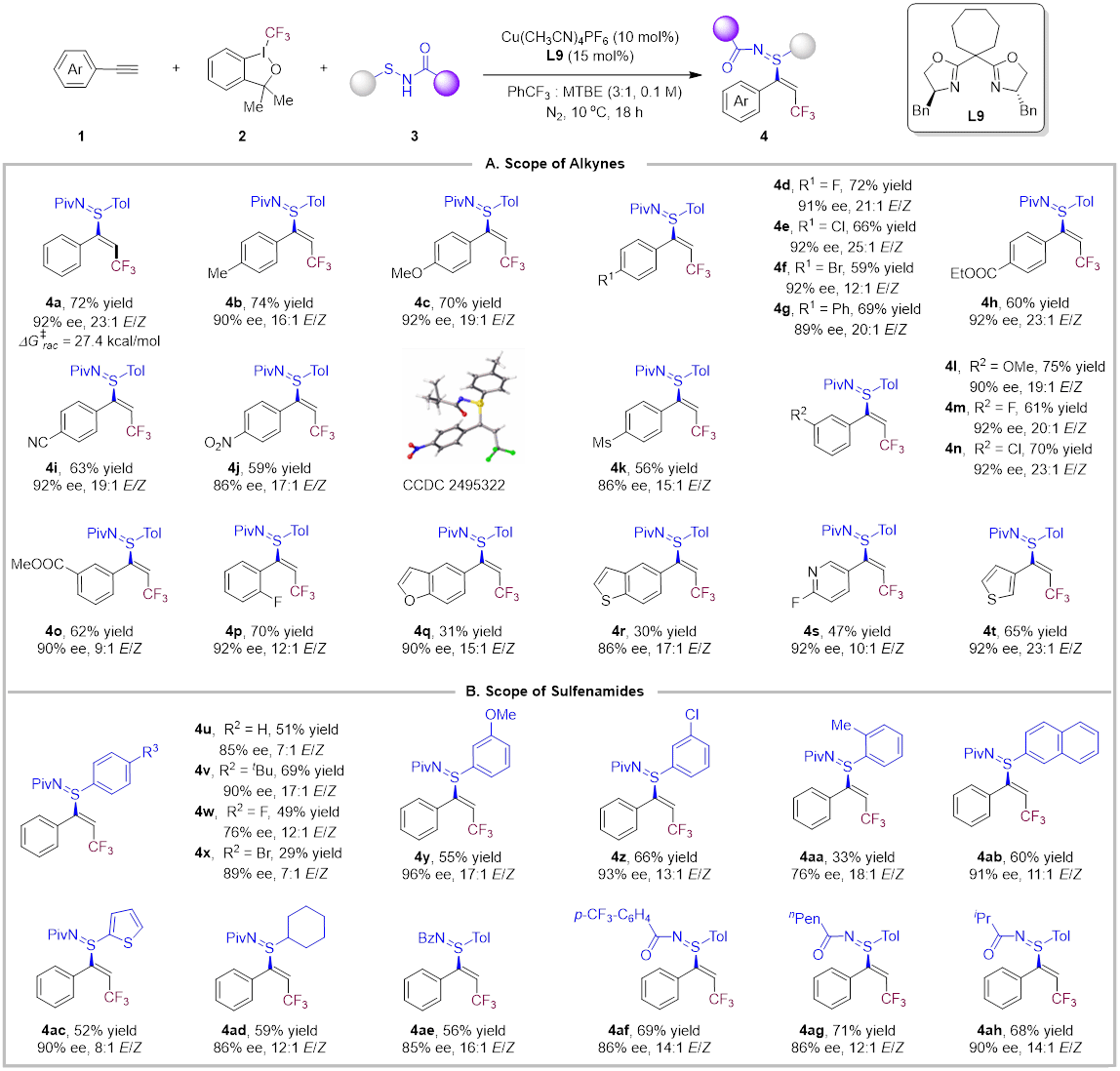
图2.单一硫中心手性反应的底物扩展
接着作者将该反应体系拓展到芳基烯基轴手性硫亚胺的构建。作者认为底物结构的选择对反应结果至关重要,因此首先对大位阻端炔进行筛选,发现不同大位阻端炔都能高对映选择性的得到目标产物,但仅NHBoc的大位阻端炔可以控制非对映选择性。在确定了定位基后,作者又对反应条件继续优化,最终确定了反应的最优条件(图3)。
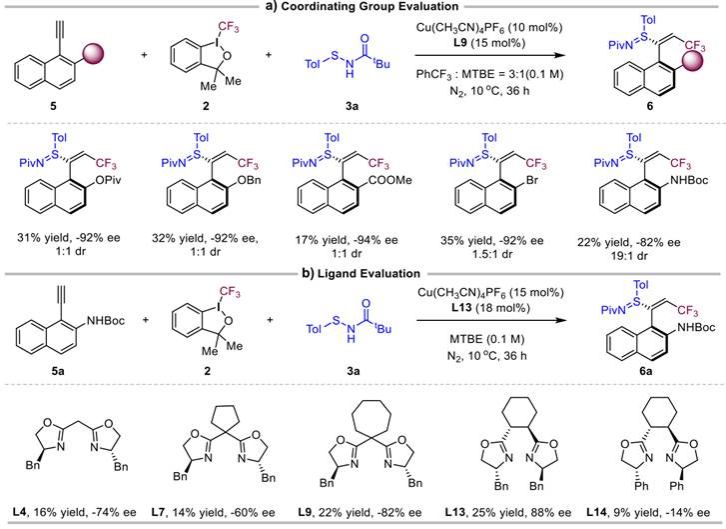
图3.芳基烯基轴手性硫亚胺反应条件的筛选
在最优条件下,考察了其底物普适性,结果表明在芳环不同位置具有吸电子和供电子基团的次磺酰胺均能很好的兼容。取代的萘环和苯环的大位阻炔烃也能以优秀的立体、对映和非对映选择性得到轴手性硫亚胺产物(图4)。

图4. 芳基烯基轴手性硫亚胺的底物范围考察
该方法还可以应用于天然产物和药物活性分子的后期修饰。此外,产物4a经氧化得到六价手性硫化合物11,然后经脱Piv和双键氢化还原,最后成功与塞来昔布衍生物偶联获得药物衍生物13,展示其在药物化学中的应用潜力(图5)。
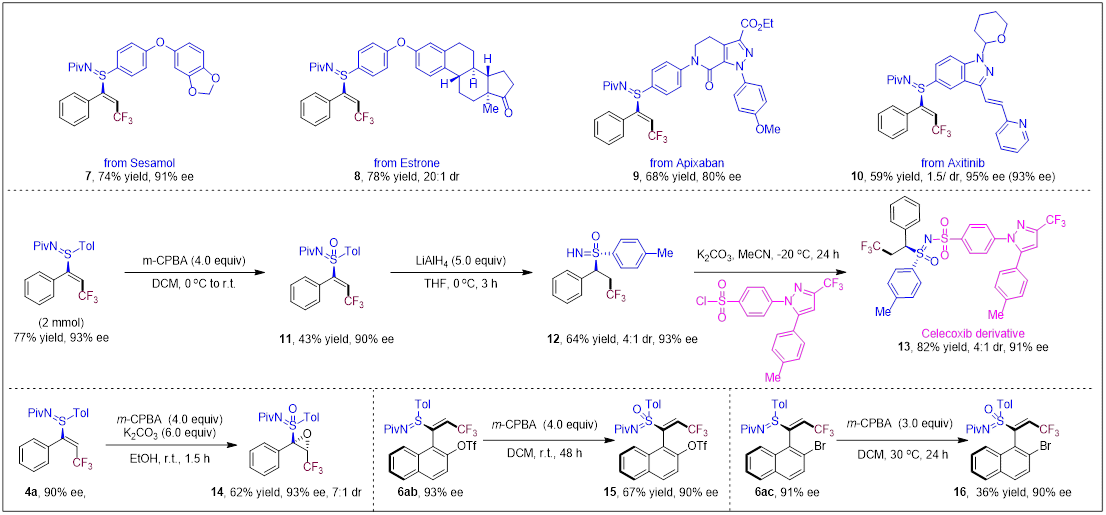
图5.合成应用
为阐明反应机理,作者进行了一系列机理实验。关键发现与结论如下:(1)自由基捕获实验和自由基钟实验,证实反应涉及自由基过程(图6A、B)。(2)氘代实验,平行动力学同位素效应(KIE)值接近于1(kH/kD = 1.0),且交叉实验中未观察到H/D交换产物,有力地排除了反应经由铜炔中间体的可能途径(图6C)。(3)产物6a的对映体纯度与手性配体L13的对映体纯度呈线性正相关,这一结果表明,在对映选择性决定步骤中,起催化作用的活性物种是铜与配体1:1配位(图6D)。(4)通过对不同对位取代的芳基次磺酰胺进行哈米特分析,得到了具有负斜率(ρ = -0.36)的线性关系。这表明富电子的次磺酰胺更有利于单电子转移过程以及随后的C–S键还原消除步骤(图6E)。基于上述实验结果及文献报道,作者提出了一个合理的反应机理:活性Cu(I)催化剂A与次磺酰胺3a经过S(II)/S(IV)互变异构-配位,形成Cu–硫亚胺物种B。B与三氟甲基化试剂2发生单电子转移,生成Cu(II)物种C和三氟甲基自由基D。自由基D对芳基炔烃5a进行自由基加成,产生芳基乙烯基自由基E。该自由基被Cu(II)物种C捕获,形成手性Cu(III)中间体F,最后经由还原消除得到目标产物6a并再生Cu(I)催化剂A,完成催化循环。其中NHBoc基团中的N−H···F相互作用及其与配体骨架之间的空间排斥效应,在反应的立体化学控制中起到了关键作用(图6F)。
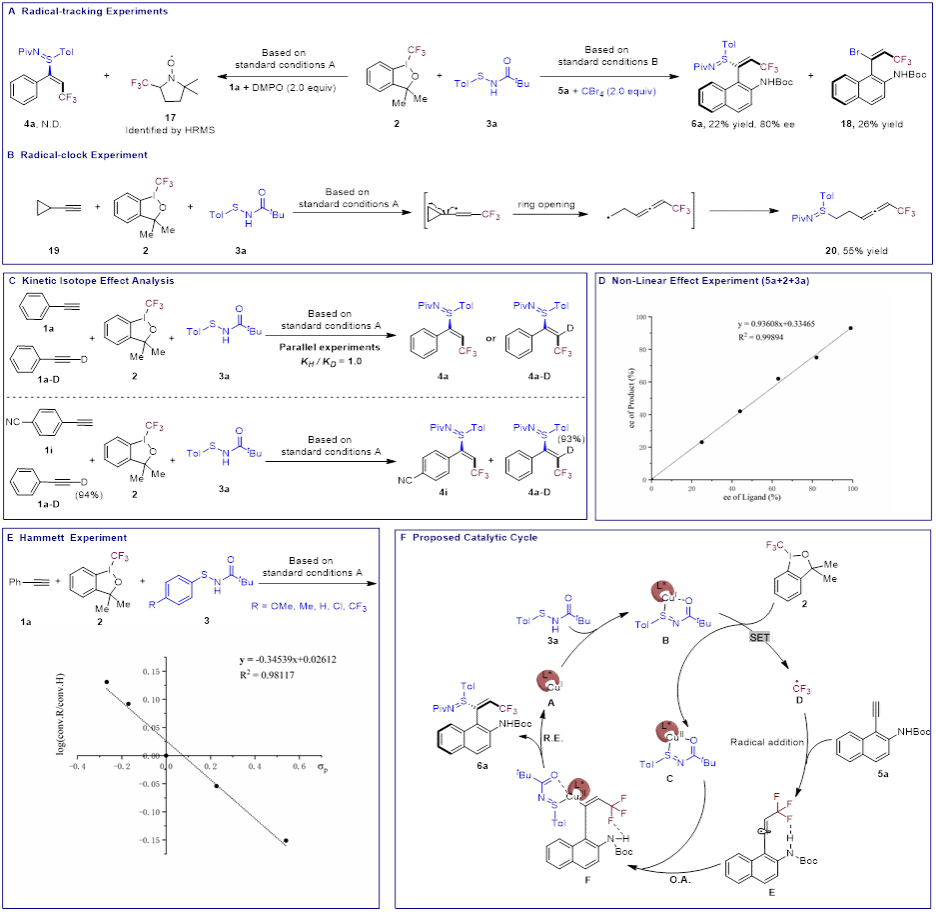
图6.机理实验及催化循环
作者开发了一种高效的铜催化三组分自由基接力策略,首次实现了轴手性乙烯基硫亚胺的高效、高选择性合成。该转化展现出优异的普适性与选择性,可兼容多种官能团化的次磺酰胺与芳香炔烃,以良好的收率及优异的化学、区域、非对映和对映选择性获得目标产物。巧妙的底物设计、自由基前体选择以及配体的调控是反应成功的关键。相关工作发表在Angewandte Chemie International Edition上。小说网
李兴伟教授、肖纪超副研究员及东北师范大学郑光范教授(计算)为共同通讯作者。小说网
为第一单位,小说网
研究生王伟和杨棋为共同第一作者。上述研究工作得到了国家自然科学基金、中央高校基本科研业务费以及小说网
的资助。同时,感谢实验中心孙华明、樊娟、郭新爱和袁书培老师在实验数据和机理研究方面提供的实验技术支持。
供稿人:肖纪超

